Электролитическая диссоциация
Самопроизвольный частичный или полный распад растворенных электролитов на ионы называется электролитической диссоциацией. Термин «ионы» введен английским физиком М. Фарадеем (1833). Теория электролитической диссоциации была сформулирована шведским ученым С. Аррениусом (1887) для объяснения свойств водных растворов электролитов. В дальнейшем она развивалась многими учеными на основе учения о строении атома и химической связи. Современное содержание этой теории можно свести к следующим трем положениям:
1. Электролиты при растворении в воде диссоциируют (распадаются) на ионы — положительно и отрицательно заряженные. («Ион» в переводе с греческого означает «странствующий». В растворе ионы беспорядочно движутся в различных направлениях.)
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные движутся к катоду, отрицательно заряженные — к аноду. Поэтому первые называются катионами, вторые — анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженных электродами.
3. Диссоциация — обратимый процесс. Это означает, что наступает такое состояние равновесия, при котором сколько молекул распадается на ионы (диссоциация), столько их вновь образуется из ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости.
Например:
KA ↔ K+ + A−,
где KA — молекула электролита, K+ — катион, A− — анион.
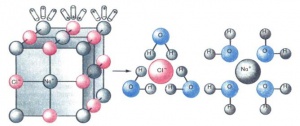
Учение о химической связи помогает ответить на вопрос, почему электролиты диссоциируют на ионы. Легче всего диссоциируют вещества с ионной связью, так как они уже состоят из ионов (см. Химическая связь). При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. Аналогично диссоциируют и электролиты, молекулы которых образованы по типу ковалентной полярной связи. Диссоциация полярных молекул может быть полной или частичной — всё зависит от степени полярности связей. В обоих случаях (при диссоциации соединений с ионной и полярной связью) образуются гидратированные ионы, т. е. ионы, химически связанные с молекулами воды.
Основоположником такого взгляда на электролитическую диссоциацию был почетный академик И. А. Каблуков. В отличие от теории Аррениуса, не учитывавшей взаимодействия растворенного вещества с растворителем, И. А. Каблуков к объяснению электролитической диссоциации применил химическую теорию растворов Д. И. Менделеева. Он показал, что при растворении происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. И. А. Каблуков полагал, что в водном растворе содержатся только гидратированные ионы. В настоящее время это представление общепринято. Итак, гидратация ионов — основная причина диссоциации. В других, неводных растворах электролитов химическая связь между частицами (молекулами, ионами) растворенного вещества и частицами растворителя называется сольватацией.
Гидратированные ионы имеют как постоянное, так и переменное число молекул воды. Гидрат постоянного состава образует ионы водорода Н+ , удерживающие одну молекулу воды,— это гидратированный протон H+(H2O). В научной литературе его принято изображать формулой H3O+ (или OH3+) и называть ионом гидроксония.
Поскольку электролитическая диссоциация — процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой а). Степень диссоциации — это отношение числа молекул, распавшихся на ионы, n к общему числу растворенных молекул N:
α = n/N
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1, или 100%, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации. С разбавлением раствора она увеличивается, а при добавлении одноименных ионов (одинаковых с ионами электролита) — уменьшается.
Однако для характеристики способности электролита диссоциировать на ионы степень диссоциации не очень удобная величина, так как она. зависит от концентрации электролита. Более общей характеристикой является константа диссоциации K. Ее легко вывести, применив закон действия масс к равновесию диссоциации электролита (1):
K = ([K+][A−]) / [KA],
где KA — равновесная концентрация электролита, [K+] и [A−] — равновесные концентрации его ионов (см. Равновесие химическое). K от концентрации не зависит. Она зависит от природы электролита, растворителя и температуры. Для слабых электролитов чем больше K (константа диссоциации), тем сильнее электролит, тем больше ионов в растворе.
Сильные электролиты констант диссоциации не имеют. Формально их можно вычислить, но они не будут постоянными при изменении концентрации.
Многоосновные кислоты диссоциируют по ступеням, а значит, такие кислоты будут иметь несколько констант диссоциации — для каждой ступени свою. Например:
H3PO4 ↔ H+ + H2PO4− — первая ступень:
K1 = [H+][H2PO4−] / [H3PO4] = 7,51•10−3 (25° C);
H3PO4- ↔ H+ + HPO42− — вторая ступень:
K2 = [H+][HPO42−] / [H3PO4−] = 6,23•10−8;
H3PO42− ↔ H+ + PO43− — третья ступень:
K3 = [H+][PO43−] / [H3PO42−] = 2,2•10−13.
Всегда K1>K2>K3, т.е. многоосновная кислота при диссоциации по первой ступени ведет себя как более сильная кислота, чем по второй или третьей.
Ступенчатой диссоциации подвергаются и многокислотные основания. Например:
Pb(OH)2 ↔ Pb(OH)+ + OH−
Pb(OH)+ ↔ Pb2+ + OH−
Кислые и основные соли также диссоциируют ступенчато. Например:
NaHSO3− ↔ Na+ + HSO3−
HSO3− ↔ H+ + SO32−
Mg(OH)Cl ↔ Mg(OH)+ + Cl−
Mg(OH)+ ↔ Mg2+ + OH−
При этом на первой ступени соль полностью распадается на ионы, что обусловлено ионным характером связи между Na+ и HSO3−; Mg(OH)+ и Cl−; диссоциация по второй ступени незначительная, так как заряженные частицы (ионы) дальнейшей диссоциации подвергаются как очень слабые электролиты.
С точки зрения теории электролитической диссоциации даются определения и описываются свойства таких классов химических соединений, как кислоты, основания, соли.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода. Например:
H2SO4 ↔ H+ + HSO4−
HSO4 ↔ H+ + SO32−
Все общие характерные свойства кислот — кислый вкус, изменение цвета индикаторов, взаимодействие с основаниями, основными оксидами, солями — обусловлены присутствием ионов водорода Н+ , точнее Н3O+ .
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы:
Ca(OH)2 ↔ Ca(OH)+ + OH−
Ca(OH)+ ↔ Ca2+ + OH−
Согласно теории электролитической диссоциации все общие щелочные свойства растворов — мылкость на ощупь, изменение цвета индикаторов, взаимодействие с кислотами, ангидридами кислот, солями — обусловлены присутствием гидроксид-ионов OH−.
Правда, имеются электролиты, при диссоциации которых одновременно образуются и ионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, в незначительных количествах диссоциирует на ионы H+ и OH−:
H2O ↔ H+ + OH−
Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленные наличием ионов водорода H+ , и щелочные свойства, обусловленные наличием ионов OH−.
Диссоциацию гидроксида цинка Zn(OH)2 можно выразить уравнением:
2OH− + Zn2+ + 2H2O ↔ Zn(OH)2 + 2H2O ↔ [Zn(OH)4]2− + 2H+
Солями называются электролиты, при диссоциации которых образуются катионы металлов (сюда же относят и катион аммония NH4+) и анионы кислотных остатков. Например:
K3PO4 ↔ 3K+ + PO43−
Так диссоциируют средние соли. Кислые же и основные соли, как уже отмечалось, диссоциируют ступенчато.
<addc>G</addc>
Поскольку все реакции в водных растворах электролитов представляют собой взаимодействие ионов, уравнения этих реакций можно составлять в ионной форме.
Значение теории электролитической диссоциации состоит в том, что она объяснила многочисленные явления и процессы, протекающие в водных растворах электролитов. Однако она не объясняет процессов, протекающих в неводных растворах. Так, если хлорид аммония в водном растворе ведет себя как соль (диссоциирует на ионы NH4+ Cl−), то в жидком аммиаке проявляет свойства кислоты — растворяет металлы с выделением водорода. Как основание ведет себя азотная кислота, растворенная в жидком фтороводороде или в безводной серной кислоте.
Все эти факторы противоречат теории электролитической диссоциации. Их объясняет протолитическая теория кислот и оснований.
Сам термин «диссоциация» означает распад молекул на несколько более простых частиц. В химии помимо электролитической диссоциации различают термическую диссоциацию. Это обратимая реакция, происходящая при повышении температуры. Например, термическая диссоциация водяного пара:
2H2O ↔ 2H2 + O2,
карбоната кальция:
CaCO3 ↔ CaO + CO2,
молекул иода: I2 ↔ 2I
Равновесие термической диссоциации подчиняется закону действия масс.