Атом
Это понятие возникло еще в античном мире (в переводе с греческого «атом» означает «неделимый»). Хотя представления об атомах использовались наукой на протяжении многих столетий, даже в конце XIX в. ученые еще не знали об устройстве атома. Он рассматривался как бесструктурная материальная частица, предел делимости вещества. Считалось, что разновидностей атомов столько, сколько может существовать химических элементов, и что все атомы данного элемента совершенно одинаковы. Ученые полагали также, что атомы неизменны, т. е. атом одного элемента не может превращаться в атом другого. Единственной количественной характеристикой атома был атомный вес (это понятие ввел в 1803 г. английский ученый Д. Дальтон, см. Атомно-молекулярное учение). Величины атомных весов химических элементов легли в основу периодического закона, открытого Д. И. Менделеевым в 1869 г.
Совершившиеся в 1890‑х гг. научные открытия рентгеновских лучей (1895), явления радиоактивности (1896) и электрона (1897) произвели революцию в естествознании и, в частности, способствовали кардинальному пересмотру представлений о структуре и свойствах материи. Английский ученый Э. Резерфорд предложил ядерную (планетарную) модель атома (1911). В ней атом рассматривался как состоящий из центрального положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов. У этой модели был существенный недостаток: вращаясь вокруг ядра, электроны постепенно теряли энергию и рано или поздно должны были упасть на ядро. Так утверждали законы классической электродинамики. Следовательно, любой атом в конечном счете был обречен на разрушение.
Противоречия резерфордовской атомной модели преодолел в 1913 г. датский физик Н. Бор, который применил к ней идею о квантах, высказанную еще в 1900 г. немецким физиком М. Планком. Электроны в атомах движутся не по всевозможным орбитам, а лишь по определенным, квантованным, как считал Н. Бор, и, находясь на них, электроны не теряют энергии. Лишь когда электрон «перескакивает» с одной орбиты на другую, его энергетическое состояние изменяется. При этом излучается или поглощается квант света — фотон. Тем самым удалось объяснить особенности и закономерности оптических спектров химических элементов (см. Спектральный анализ). Так сформировалось представление о современной модели атома, которую называют моделью Резерфорда — Бора.
Что касается строения атомного ядра, то сначала полагали, что оно состоит из протонов и ядерных электронов. Протонно‑электронная модель встречала все большее число противоречий, пока не появились серьезные сомнения в её справедливости. Открытие в 1932 г. нейтрона позволило советскому ученому Д. Д. Иваненко и немецкому В. Гейзенбергу предложить протонно‑нейтронную модель ядра, которая и стала общепринятой.
Итак, атом — мельчайшая частица химического элемента — оказался сложным, а во многих отношениях и уникальным материальным образованием природы. Он построен из трех видов элементарных частиц — протонов, нейтронов и электронов, причем эти частицы принадлежат к разным классификационным группам. Ядерные протоны и нейтроны (их часто объединяют общим названием «нуклоны») относятся к барионам, тогда как электроны — к лептонам. Атом как устойчивая материальная структура интересен еще и тем, что в нем проявляются различные виды так называемых фундаментальных взаимодействий: сильное, электромагнитное, слабое и гравитационное. Они резко отличаются друг от друга по интенсивности и по радиусу действия.
В основе ядерных сил, которые действуют между протонами и нейтронами в ядре, лежит сильное взаимодействие. Радиус его действия не превышает 10−13 см; именно такие линейные размеры имеют атомные ядра.
В ядерных силах важную роль играет и электромагнитное взаимодействие (отталкивание между протонами), но главной сферой его действия является структура атома в целом (притяжение электронов к ядру, взаимодействие между электронами). Именно оно определяет строение электронных оболочек атома. По существу, вся химия основана на электромагнитном взаимодействии. По интенсивности оно примерно в 100 раз «слабее» сильного. Поэтому линейные размеры атома превосходят размеры ядра примерно в 105 раз, и средние линейные размеры атома определяются величинами 10−8 см. Таким образом, средний объем ядра (10−36 см3) оказывается незначительным по сравнению со средним объемом атома (10−24 см3).
Слабое взаимодействие лежит, в частности, в основе объяснения β‑нестабильности ядер (см. Радиоактивность). Оно примерно в 1010 раз менее интенсивно, чем сильное.
Наконец, гравитационное взаимодействие — наиболее слабое из всех четырех видов, радиус его действия безграничен, и ему подчинена вся материя (назовем хотя бы закон всемирного тяготения). Какую именно роль гравитационное взаимодействие выполняет в атомах, пока еще не выяснено.
Одна из уникальных особенностей атома состоит в том, что для него характерна сферичная пространственная симметрия.
Учение о строении атома сыграло колоссальную роль в химии и физике XX в. В частности, на основе атомной модели были вскрыты глубинные физические причины периодического изменения свойств химических элементов и развита теория периодической системы Менделеева. Здесь решающее значение имело установление закономерностей формирования электронных конфигураций атомов по мере роста Z — заряда атомного ядра (см. Периодическая система химических элементов).
В 1913 г. нидерландский ученый А. ван ден Брук предположил, а английский физик Г. Мозли доказал, что заряд ядра атома Z численно равен порядковому номеру соответствующего элемента в периодической системе. Тем самым атомная модель была связана с периодической системой элементов. Н. Бор установил основные закономерности формирования электронных конфигураций атомов по мере роста Z и объяснил физическую причину периодического изменения свойств химических элементов.
Атомистика конца XIX в. объявляла атомы неизменными, отрицала возможность превращения атомов одного элемента в атомы другого. Изучение явления радиоактивности опровергло это положение. Оказалось, что радиоактивное излучение сопровождается превращаемостью элементов. В 1919 г. Э. Резерфорд впервые наблюдал явление искусственного превращения элементов: азот, облучавшийся α‑частицами, превращался в кислород. В настоящее время известно несколько десятков типов ядерных реакций, приводящих к превращению химических элементов.
Атомистика конца прошлого века преимущественно полагала, что число разновидностей атомов соответствует числу существующих на Земле химических элементов. И этот её тезис оказался неправильным. В начале XX в. было открыто около 40 радиоактивных веществ. Среди них обнаруживались такие совокупности, члены которых, хотя и различались по величине атомного веса, оказывались совершенно идентичными по своим химическим и спектральным характеристикам. Разновидности атомов радиоактивных элементов, имеющие одинаковые химические свойства и в то же время различающиеся по атомным весам, английский ученый Ф. Содди в 1913 г. назвал изотопами. Вскоре было показано (главным образом, благодаря работам английского физика Ф. Астона), что и многие стабильные элементы являются смесью нескольких изотопов.
<addc>l</addc>
Сейчас известно около 2000 разновидностей атомов химических элементов. Из них примерно 280 приходится на долю стабильных изотопов; 46 — на долю природных, естественно радиоактивных изотопов, сгруппированных в радиоактивные семейства тория‑232, урана‑238 и урана‑235. Все остальные получены искусственно, в том числе более 150 изотопов трансурановых элементов. Пока неизвестен предел существования атомов по величине Z. На сегодняшний день удалось синтезировать атомы с значением Z более 110.
Важнейшая количественная характеристика атома — его атомная масса. В качестве единицы атомной массы принята 1/12 часть средней массы природного углерода, состоящего из двух изотопов с массами 12 и 13. Ранее употреблялась кислородная шкала O=16. Атомные массы последовательно возрастают по мере увеличения Z. Только в трех случаях (аргон — калий, кобальт — никель и теллур — иод) атомная масса предыдущего элемента больше атомной массы последующего.
Другой важной количественной характеристикой атома является его радиус. Величины радиусов рассчитываются теоретически, поскольку экспериментальных методов их определения не существует. Ныне используют значения так называемых орбитальных радиусов. В среднем они соответствуют расстояниям от ядра до максимума плотности электронов на отдельных орбиталях атомов. Радиус внешней орбитали определяет величину атомного или ионного орбитального радиуса (они обозначаются как rорб и rn+орб соответственно). Величины орбитальных радиусов периодически изменяются по мере роста Z. Они имеют максимальные значения у атомов щелочных металлов и минимальные — у атомов инертных газов.Расчеты показывают, что наибольшее значение горб из всех известных элементов достигает у атома цезия (2,518), тогда как у его тяжелого аналога франция орбитальный радиус меньше (2,447). По «привычным» меркам размеры атомов ничтожны (порядка 10−8 см). Однако благодаря применению специальных электронных микроскопов удалось сфотографировать отдельные атомы тяжелых элементов (например, урана).
Наконец, в атомистике давно использовалась величина атомного объема. Это объем 1 грамм‑атома элемента, равный частному от деления атомной массы на плотность простого вещества в твердом состоянии. По величине атомного объема можно составить представление о пространстве, которое занимает атом того или иного элемента, поскольку 1 грамм‑атом любого элемента содержит 6,0238•1023атомов. Кривая изменения атомных объемов в зависимости от Z также имеет периодический характер.
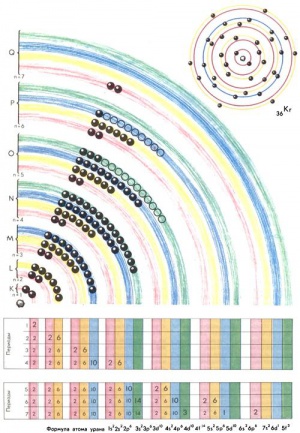
Согласно теории Н. Бора, который разработал представления о последовательности формирования электронных конфигураций атомов по мере роста Z, электроны группируются в определенные оболочки. Каждая из оболочек (их последовательность изображается латинскими буквами K, L, M, N, O, P, Q) содержит конечное число электронов: K‑оболочка, ближайшая к ядру, — 2, вторая (L) — 8, третья (M) — 18, четвертая (N) — 32 электрона и т. д. Отсюда видно, что емкость оболочек описывается выражением 2n2, где n — номер оболочки. В свою очередь, электроны каждой оболочки группируются в подоболочки, причем число подоболочек равно номеру оболочки; их принято обозначать латинскими буквами s, p, d, f, g…, а количества электронов в них соответственно равны 2, 6, 10, 14, 18…
В соответствии с представлениями Н. Бора реальная схема формирования электронных конфигураций атомов в зависимости от возрастания Z записывается следующим образом:
1s22s22p64s23d104p65s24d105p66s24f145d10
Причем эта последовательность не вытекает из какой‑либо строгой физической теории, а опирается, в частности, на особенности химических свойств элементов и характеристики их спектров.
Хотя представления Бора широко используются до сих пор, действительная физическая модель атома была создана благодаря квантовой механике. В квантовомеханической модели атома состояние каждого электрона описывается так называемой волновой функцией или атомной орбиталью. Волновые функции выводятся из уравнения, предложенного в 1926 г. австрийским физиком Э. Шрёдингером. С точки зрения математики, это дифференциальное уравнение второго порядка в частных производных:
В этом уравнении m — масса электрона, e — его заряд, r — расстояние от ядра, E — полная энергия электрона, x, y, z — координаты электрона, h — постоянная Планка. Уравнение Шрёдингера имеет точное решение только для атома водорода. Что касается величины ψ, то она и является волновой функцией (см. Квантовая химия).
Каждая атомная орбиталь описывается тремя целочисленными квантовыми числами: главным (n), орбитальным (l) и магнитным (ml). Главное квантовое число n в принципе может принимать любое целочисленное значение, начиная с 1; атомы всех известных в настоящее время элементов не содержат электронов, отвечающих атомным орбиталям с n > 7. Таким образом, n характеризует энергию электрона на соответствующей орбитали и чем оно меньше, тем меньше орбитальная энергия электрона (причем эти энергии имеют отрицательное значение). Кроме того, n определяет размер соответствующего электронного облака: чем больше n, тем более электрон удален от ядра.
Второе, орбитальное (или побочное) квантовое число l может принимать любые значения от 0 до n − 1. При этом для n = 1 l может равняться только 0; для n = 2 l = 0 и 1; для n = 3 l = 0, 1 и 2; для n = 4 l = 0, 1, 2 и 3… Это квантовое число определяет значение орбитального момента количества движения электрона, находящегося на данной орбитали, и форму соответствующего электронного облака.
Третье, магнитное квантовое число ml принимает любые значения от −l до +l, включая нулевое, т. е. ml = 0, ±1, ±2, ±3… ±l. Оно характеризует расположение соответствующей орбитали в пространстве атома. Отсюда следует, что значению l = 0 (s‑электроны) отвечает только одна орбиталь; l = 1 (р‑электроны) — три орбитали; l = 2 (d‑электроны) — пять орбиталей и l = 3 (f электроны) — семь орбиталей.
И все-таки квантовые числа n, l, ml еще не дают исчерпывающего определения движения электронов в атомах. Электроны в атомах различаются еще одной характеристикой — собственным моментом количества движения, называемым спином. Этот момент описывается квантовым числом ms — спиновым, которое может иметь только два значения: −1/2 и +1/2.
Перечисленные четыре квантовых числа (n, l, ml, ms) в общем и целом характеризуют движение электронов в атоме. Каких‑либо других численных характеристик атома, которые не зависели бы от этой «четверки», не существует. Они определяют энергию электрона, размер и форму электронного облака и спиновой момент. В атоме не может быть двух электронов, характеризующихся одинаковыми значениями всех четырех квантовых чисел. Это фундаментальное правило носит название принципа Паули (в честь швейцарского физика‑теоретика В. Паули, сформулировавшего его).
Однако даже квантовомеханическая модель атома не внесла окончательной ясности в фундаментальные закономерности формирования электронных конфигураций атомов. Это задача науки будущего.