Фазовые превращения
Переходы вещества из одной фазы в другую при изменении состояния системы называют фазовыми превращениями. Фаза — совокупность телесных объектов, имеющих определенный химический состав и термодинамические свойства, отделенная от других фаз поверхностью раздела. Или иначе: фаза — это однородная часть неоднородной системы, которая может быть выделена из системы каким‑либо механическим способом. Существует, как правило, одна газовая фаза (за исключением редких случаев расслоения газовых смесей при очень высоких давлениях). Число жидких и особенно твердых фаз может быть достаточно велико.
Основная характеристика фазовых превращений — температура, при которой фазы находятся в состоянии термодинамического равновесия, — точка фазового перехода. В 1933 г. профессор Лейденского университета в Нидерландах П. Эренфест предложил классификацию фазовых переходов. Согласно этой классификации, для фазовых переходов первого рода характерно, что в точке фазового перехода наблюдается выделение или поглощение тепла ([math]q[/math]) и изменение объема ([math]Δv[/math]). К фазовым переходам первого рода относятся, например, превращение твердого тела в жидкое (плавление) и обратный процесс (кристаллизация), жидкого — в пар (испарение, кипение), одной кристаллической модификации — в другую (полиморфные превращения) и др. При фазовых переходах второго рода тепловой и объемный эффекты отсутствуют, зато в точке перехода наблюдается изменение теплоемкости, объемного коэффициента теплового расширения, сжимаемости. К фазовым переходам второго рода относят, например, переход нормального проводника в сверхпроводящее состояние (см. Сверхпроводимость), гелия I — в сверхтекучий гелий II (см. Сверхтекучесть), ферромагнетика — в парамагнетик (см. Магнетизм) и т. д.
Состояние фазового равновесия характеризуется определенной связью между температурой фазового превращения и давлением. Так, температура плавления или кипения зависит от внешнего давления, а давление насыщенного пара имеет вполне определенное значение при данной температуре. Численно эта зависимость для фазовых переходов первого рода дается уравнением Клапейрона—Клаузиуса, согласно которому [math]Δp/ΔT=q/TΔv.[/math] Поскольку при плавлении тепло поглощается ([math]q\gt 0[/math]), а объем жидкой фазы обычно больше объема твердой ([math]Δv\gt 0[/math]), то температура плавления, как правило, растет с увеличением давления. Исключение составляют случаи, когда объем при затвердевании возрастает (висмут, галлий, вода, чугун). Эффект обычно мал, порядка [math]{{10}^{−2}}[/math] К/атм. Давление насыщенного пара всегда растет с ростом температуры.
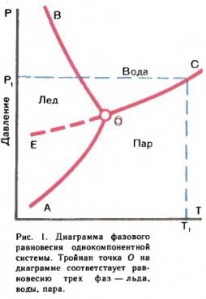
Фазовое равновесие удобно изображать с помощью диаграмм. Для простейшей однокомпонентной системы, состоящей из одного вещества, например воды, такая диаграмма приведена на рис. 1. Ниже линий [math]OA[/math] и [math]OC[/math], т. е. при низких давлениях и высоких температурах, находится область, отвечающая устойчивости пара, между линиями [math]OB[/math] и [math]OC[/math] — жидкости и между линиями [math]OA[/math] и [math]OB[/math] — твердого льда. Внутри каждой из этих областей можно произвольно и независимо менять два параметра — температуру [math]T[/math] и давление [math]p[/math], оставаясь в области устойчивости одной из фаз.
Состояния системы, описываемые линиями [math]OA,[/math] [math]OB[/math] и [math]OC,[/math] соответствуют равновесию между двумя фазами, например [math]OC[/math] — равновесию между водой и паром.
В точке пересечения всех трех кривых, так называемой тройной точке, находятся в равновесии три фазы (лед, вода, пар). В тройной точке температура и давление строго заданы (например, для воды [math]0,0078°C[/math] и [math]4,579[/math] мм рт. ст.).
Пунктирная линия [math]OE[/math] на рис. 1, являющаяся продолжением линии [math]OC[/math], показывает зависимость давления пара переохлажденной воды от температуры. Оно, очевидно, всегда выше, чем давление пара льда. Такая фаза неустойчива (метастабильна) в присутствии более устойчивой фазы. Возможность существования метастабильиых фаз (перегрева и переохлаждения) — характерная особенность фазовых переходов первого рода. Перегрев и переохлаждение связаны с необходимостью затраты энергии на образование зародышей новой фазы (кристалликов льда, капелек жидкости, пузырьков пара). Если для перевода пара и жидкости в другую фазу приходится прибегать к разным ухищрениям (например, пузырьки пара легко образуются на пылинках, значит, перегретая вода должна быть предельно чистой), то для кристаллов возможность длительно, устойчиво существовать в неустойчивых фазах — почти что правило. Так, вполне устойчив алмаз, который при комнатной температуре и атмосферном давлении должен быть графитом. Белое олово должно превращаться в порошок серого олова (оловянная чума) при [math]18°C.[/math] Однако известно, что оно спокойно выдерживает переохлаждение на [math]20[/math]–[math]30[/math] градусов. И все же в условиях суровой зимы превращение олова происходит. Незнание этого было одной из причин гибели экспедиции Р. Скотта на Южный полюс в 1912 г. Запасы жидкого топлива экспедиции находились в сосудах, запаянных оловом. При больших холодах сосуды распаялись, и топливо вытекло.
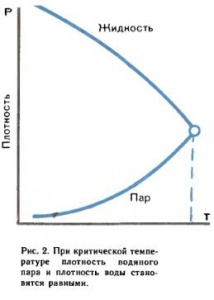
На поверхности раздела, отделяющей одну фазу от другой, свойства обычно меняются скачком. Так, например, плотность водяного пара много меньше плотности воды. Но если повышать температуру, они сближаются (рис. 2) и при некоторой критической температуре становятся равными. Критической называют температуру, при которой исчезает различие в физических свойствах между жидкостью и насыщенным паром. Соответствующее давление называется критическим давлением. При температурах ниже критической существуют два легко отличимых состояния воды — пари жидкость. При температурах выше критической вещество находится в однородном парообразном состоянии. Если уменьшать объем, занятый этим паром,то давление возрастает, но пар не превращается в жидкость. Двух состояний с резкой границей нельзя получить ни при каком давлении (как это бывает ниже критической температуры из‑за конденсации пара). Поэтому так долго не удавалось М. Фарадею сконденсировать кислород и водород путем увеличения давления; их нужно было охладить ниже критической температуры.
<addc>G</addc>
Для каждого вещества характерны свои критические температура и давление. Например, для ртути это [math]1730°C[/math] и около [math]1640[/math] атм, для воды — [math]374°C[/math] и [math]218,4[/math] атм, углекислого газа — [math]31°C[/math] и [math]73[/math] атм, кислорода — [math]−118°C[/math] и [math]50[/math] атм, водорода — [math]−240°C[/math] и [math]12,8[/math] атм, гелия — −[math]268°C[/math] и [math]2,26[/math] атм. Удельная теплота парообразования уменьшается с ростом температуры и при критической температуре равна нулю.
Температура фазового перехода второго рода также зависит от давления. Но, как уже говорилось, тепловой и объемный эффекты равны нулю, и зависимость эта определяется изменением в точке фазового перехода теплоемкости, коэффициента расширения и сжимаемости.
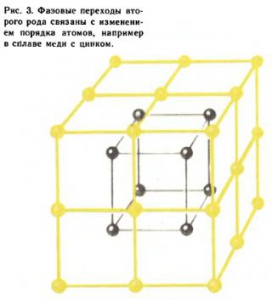
Фазовые переходы второго рода связаны с изменением порядка. Это можно понять на примере фазового перехода в бета‑латуни — сплаве меди с цинком. Атомы меди, изображенные на рис. 3 светлыми кружками, расположены в вершинах куба, атомы цинка (темные кружки) — в центре (или наоборот). При идеальном порядке каждый атом меди имеет в качестве ближайших соседей только атомы цинка. Но при повышении температуры увеличивается вероятность для атома занять «чужой» узел. До тех пор пока эти вероятности ([math]{{w}_{1}}[/math] — вероятность занять «свой» узел и [math]{{w}_{2}}[/math] — «чужой») разные (атомы больше «сидят» в «своих» «узлах»), узлы неэквивалентны, и симметрия (две кубические решетки, вставленные одна в другую, со сдвигом на половину объемной диагонали) не меняется. Это низкотемпературная упорядоченная фаза. Однако при некоторой температуре, большей или равной температуре фазового перехода ([math]{{T}_{c}}[/math] — точка Кюри, названная по имени французского физика П. Кюри, открывшего, в частности, в 1895 г. существование температуры [math]{{T}_{c}}=770°C[/math], выше которой исчезают ферромагнитные свойства железа), становится [math]{{w}_{1}}={{w}_{2}}[/math]. Теперь все узлы эквивалентны, и симметрия повышается: бета‑латунь имеет решетку объемно-центрированного куба. Возникла высокотемпературная разупорядоченная фаза с новой, более высокой симметрией (рис. 4).
Можно ввести степень порядка [math]\eta =({{w}_{1}}-{{w}_{2}}):({{w}_{1}}+{{w}_{2}}).[/math] В полностью упорядоченном состоянии, при абсолютном нуле температуры, [math]{{w}_{1}}=1,[/math] [math]{{w}_{1}}=0[/math] (все атомы «сидят» в «своих» узлах) и η = 1, а в полностью разупорядоченном ([math]T≥{{T}_{c}}[/math])[math]\quad{{w}_{1}}={{w}_{2}}=1/2[/math] (все узлы одинаковы) и [math]η=0.[/math] При любом как угодно малом [math]η\gt 0[/math] симметрия та же, что и у вполне упорядоченной фазы. Аналогичным образом объясняются и другие фазовые переходы второго рода. Так, железо ниже [math]{{T}_{c}}[/math] обладает ферромагнитными свойствами, а выше — парамагнитными (см. Магнетизм). Исчезновение ферромагнетизма при нагревании связано с изменением порядка в расположении магнитных моментов — спинов.
Вблизи [math]{{T}_{c}}[/math] степень порядка сколь угодно близка к нулю. Поэтому фазовый переход второго рода не требует затрат энергии: тепловой и объемный эффект равны нулю. Этим же объясняется то, что неупорядоченный сплав нельзя переохладить до упорядоченного состояния.