Аллотропия
Аллотропия — это способность некоторых химических элементов существовать в виде двух или нескольких простых веществ, различных по строению и свойствам. Еще в XVIII в. был установлен удивительный факт: и алмаз, и самый обычный уголь при сгорании образуют углекислый газ — и ничего более. Следовательно, алмаз и уголь состоят из одного и того же элемента — углерода. Ученые знали также, что сера может существовать в разных кристаллических состояниях. Позже удалось обнаружить два «фосфора» — белый и красный. Все эти примеры обобщил в 1841 г. шведский химик Й. Берцелиус и предложил для этого явления название «аллотропия» (от греческих слов αλλος и τροπος, означающих «другой» и «путь»).
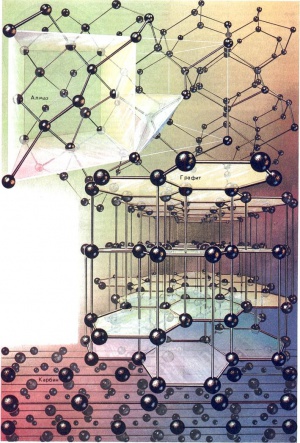
В настоящее время известно более 400 аллотропических разновидностей простых веществ. Что же лежит в основе аллотропии? Единой причины, обусловливающей существование аллотропических видоизменений, нет. Например, в молекулах таких модификаций могут содержаться разные количества атомов, как у кислорода и озона (O2 и O3). Подобное различие характерно и для молекул двух разновидностей жидкой серы: S8 и S6, но здесь есть и другая разница. В молекуле S8 атомы серы образуют восьмичленное кольцо, тогда как молекулы S6 — это линейные цепочки из шести атомов серы. Наиболее известным примером аллотропических видоизменений служат алмаз, графит и карбин (см Углерод). Карбин был впервые получен в 1961 г. советскими учеными. Он представляет собой своеобразный линейный полимер углерода. Раньше ошибочно считали аллотропической разновидностью углерода сажу, однако ее кристаллическое строение оказалось подобным графиту. В кристалле алмаза все атомы углерода соединены между собой очень прочными связями и образуют в пространстве непрерывный трехмерный каркас. В графите атомы углерода располагаются параллельными слоями; при этом атомы внутри слоя связаны между собой прочнее, чем один слой с другим. В кристаллах карбина длинные цепочки атомов уложены параллельно друг другу.
Наряду с аллотропией известно явление полиморфизма — способности одного и того же простого вещества существовать в разных кристаллических формах.
Строением кристаллов различаются, например, ромбическая и моноклинная сера, белое и серое олово.
Известное явление «оловянной чумы» — это не что иное, как переход белого олова в серое при низких температурах.
Три кристаллические модификации известны у железа, их принято обозначать греческими буквами α, β и γ.
Но больше всего аллотропических модификаций — шесть — образует плутоний. Эти разновидности имеют разные кристаллические решетки и последовательно переходят одна в другую при повышении температуры от 0° до 640° C (при этой температуре плутоний плавится).